Die seit mehr als 100 Jahren bestehende Ordnungszahl „36“ von Krypton ist unrichtig! In diesem Beitrag wird am Beispiel von Krypton verdeutlicht, dass schon die Grundlage zur Erklärung der atomaren Verhältnisse Kryptons, wie auch aller anderen Elemente, auf einem Irrtum beruht. Das für die chemischen Eigenschaften der Elemente entscheidende System befindet sich nicht in einer wie auch immer gearteten Atomhülle, sondern ist das System der Protonen und Neutronen. Die Abbildungen vom schachbrettartigen Aufbau des Edelgases Kryptons zeigen, warum die Ordnungszahl von Krypton zwingend „42“ sein muss. In Fachliteratur und -medien wird Krypton oft wie folgt beschrieben: Das Edelgas Krypton, mit der Ordnungszahl 36 ist aufgrund seiner mit Elektronen vollständig gefüllten Valenzschale der Atomhülle nur gering reaktiv und geht nur wenige Verbindungen mit anderen Atomen ein. Anwendungen von Krypton findet man insbesondere im Bereich von Leuchtmitteln und Dämmmitteln für Fensterscheiben. Eine andere Verwendung findet Krypton in Verbindung mit Fluor zu KrF2 womit es als Oxidationsmittel in chemischen Verfahren eingesetzt wird (vgl. Krypton: 2019). Krypton verfügt über insgesamt 32 nachgewiesene Isotope, von denen 6 Isotope des mittleren Massenbereichs stabil sind. Inklusiv der künstlichen Isotope reichen sie von Krypton 69 bis zu Krypton 101. Den höchsten Anteil am Isotopengemisch Kryptons hat dabei Krypton 84 mit etwa 57% (vgl. Krypton-Isotope: 2020).
Einschub: Der Atomaufbau wird seit E. Rutherfords und N. Bohrs Atommodell von der Wissenschaft mit einer Kern-Hülle-Atomvorstellung erklärt. Mit seinem „Aufbauprinzip“ von 1921 schuf Bohr zudem ein Erklärungsmodell für die chemischen Eigenschaften der Atome, das prinzipiell auch heute noch gültig ist. Ganz im Gegensatz zu D. Mendelejew und L. Meyer, den Schöpfern des PSE, machte Bohr die chemischen Eigenschaften vom fast masselosen Elektronensystem der Atomhülle abhängig (vgl. Bohr 1924:6). Mendelejew und Meyer hingegen sahen die Abhängigkeit der chemischen Eigenschaften von der Atommasse (damals Atomgewichte), (vgl. Mendelejew 1870:144, Meyer 1870:358f.). Nach heutiger Lehrmeinung verfügt Krypton, wie alle Edelgase über eine äußere Valenzschale bzw. über äußere Orbitale, die mit 8 Elektronen die sog. Oktettregel erfüllen. Die anderen elektrisch negativen 26 Elektronen verteilen nach dieser Theorie auf die näher am Atomkern befindlichen Schalen oder Orbitale. Da sich im Atomkern ebenso viele elektrisch positive Protonen wie Elektronen in der Atomhülle befinden ist das Atom elektrisch ausgeglichen. Zusammen mit den 48 neutralen Neutronen bestimmen die Protonen nach heutiger Auffassung die Atommasse „84 u“. Dennoch ist die Anordnung der Nukleonen im Kern bis heute unklar. Zum einen wird der Atomkern als aus Protonen und Neutronen zusammengeballte Kugel vermittelt zum anderen aber werden Protonen und Neutronen auch als Nukleonenpaare aufgefasst, bei denen Proton und Neutron sowohl Spin up als auch Spin down aufweisen können. Alle chemischen Eigenschaften der Atome haben danach nichts mit dem Atomkern zu tun, sondern werden vom Elektronensystem der Atomhülle bestimmt.
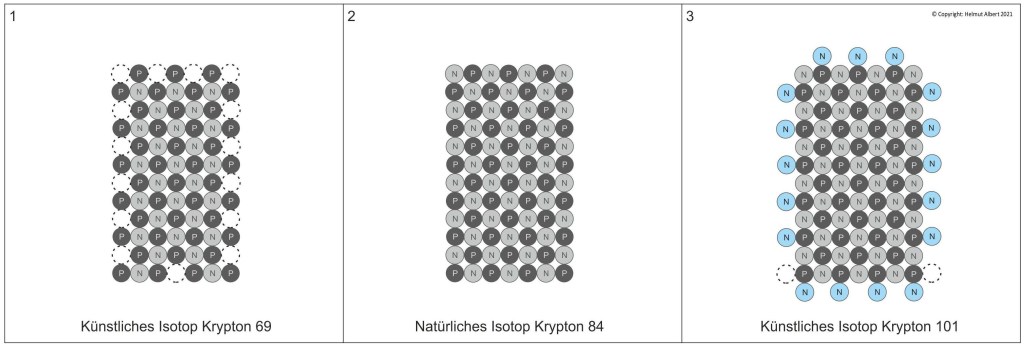
Der schachbrettartige Atomaufbau von Krypton
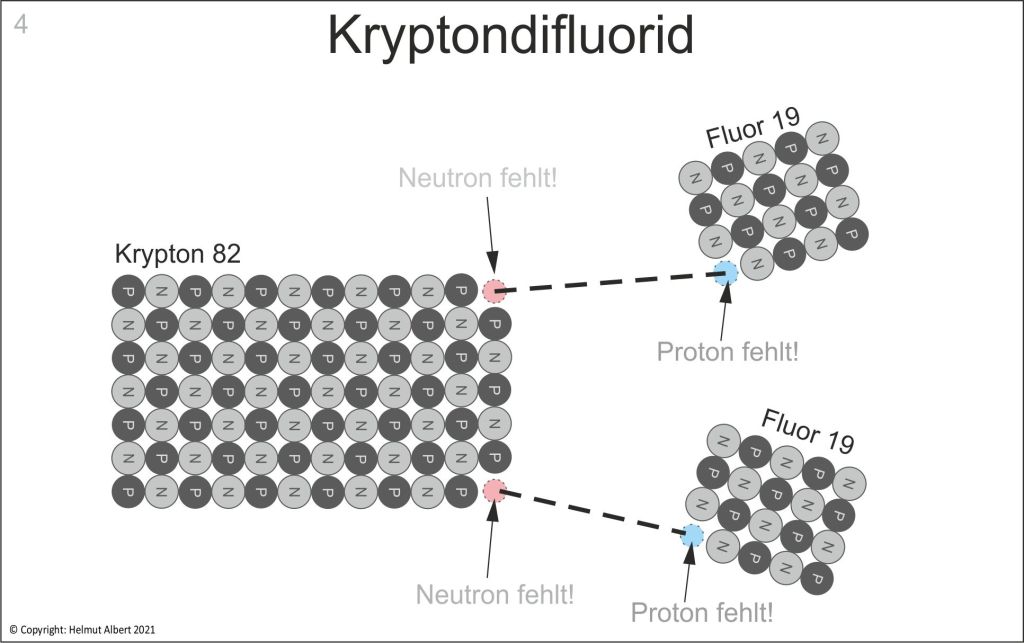
Im Gegensatz zur Vorstellung eines kugelartigen Kern-Hülle-Atoms steht die Theorie des schachbrettartigen Atomaufbaus. Nach dem schachbrettartigen Atomaufbau bauen sich die schweren Atome in Siebenerreihen auf. Das bedeutet, dass Krypton 84 über 12 x 7 Nukleonenreihen verfügen muss. Ebenso wie den Edelgasen Argon, Neon und Helium bildet auch Krypton im Grundzustand eine geschlossene Protonen-Neutronen-Konfiguration (vgl. Albert 2017: 46). Diese vollständig besetzten Atomrechtecke sind nicht reaktiv und stellen Edelgaskonfigurationen dar, womit sie im Gegensatz zu den unvollständigen und reaktiven Atomrechtecken der Elemente der 1. – 7. Hauptgruppe stehen. Geht ein Edelgas dennoch eine Bindung ein, wie bei Xenon oder Krypton, ist das nur durch Isotope möglich, die über unbesetzte Nukleonenplätze verfügen. Im Fall der Atombindung von Krypton und Fluor muss es sich um Krypton 82 handeln, denn in diesem Fall fehlen zwei Neutronen in einer oder beiden äußeren Siebenerreihen von Krypton(S. Abb. 4). Nur so ist eine Bindung zwischen Krpyton und Fluor-Ionen möglich. Betrachten wir uns die möglichen Isotope von Krypton nach dem schachbrettartigen Atomaufbau. Ein Blick auf eine Isotopen-Tabelle zeigt das Spektrum der Isotope von Krypton 69 bis 101. Davon gelten sechs Isotope als stabil, Krypton 78, 80, 82, 83, 84 und 86. Wobei Krypton 84 mit etwa 57% als stabilstes Isotop deutlich hervorsticht (vgl. Krypton-Isotope: 2020).
Der Grund warum gerade Krypton 84 das Edelgas im Grundzustand ist, ist leicht verständlich. Mit 12 x 7 Nukleonen bildet Krypton im schachbrettartigen Atomaufbau ein geschlossenes Atomrechteck mit einem nach außen elektrischem NULL-Potenzial. Das gleiche gilt für alle anderen Edelgase im Grundzustand. Aufgrund des schachbrettartigen Aufbaus der Atome verfügt Krypton 84 über genauso viel Protonen wie Neutronen, also 42 Protonen und 42 Neutronen (vgl. Albert 2017: 46). Deshalb ist die Ordnungszahl von Krypton 84 „42“ und nicht „36“, wie man bisher glaubte. Natürlich werden dadurch, im PSE, die Ordnungszahlen verschoben und einige Elemente müssen ergänzt werden.
Krypton-Isotope 69 – 101
Um nun zu erklären warum das kleinste Isotop von Krypton, Kr 69 (Abb. 1) und das schwerste Isotop Kr 101 (Abb. 3) ist, müssen wir den schachbrettartigen Aufbau von Krypton betrachten. Das Atomrechteck von Krypton 84 (Abb.2) zeigt einen Atomaufbau mit 12 x 7 Nukleonen.
Warum gibt es kein leichteres Isotop mehr als Krypton 69? Diese Frage ist mit den bisherigen Atomvorstellungen nicht erklärbar, sie ist aber sehr wohl mit dem schachbrettartigen Atomaufbau erklärbar! Wir erkennen in der Draufsicht von Krypton 69 schnell, dass kein weiteres Neutron entnommen werden kann, ohne, dass die das Element bestimmende Protonenanordnung zerstört wird. Das ist der Grund dafür, dass Krypton 69 das leichteste Krypton-Isotop ist. Umgekehrt verhält es sich beim schwersten Krypton-Isotop Kr 101. Dieses instabile Isotop verfügt über 17 Neutronen mehr als Kr 84, wie die Draufsicht zeigt. An zwei Ecken des Atomrechtecks sind theoretisch noch 2 Plätze mit Neutronen besetzbar um Krypton 103 zu erreichen. Doch damit ist die Grenze nach oben erreicht und schwerere Krypton-Isotope sind unmöglich. Es ist wahrscheinlich, dass bei der Streuung von Neutronen an Krypton die gegenseitigen Abstoßungskräfte der Neutronen in den Eckbereichen so stark sind, dass maximal nur das Krypton-Isotop 101 künstlich erzeugbar ist.
Wie aber ist es möglich, dass das Edelgas Krypton eine Bindung mit Fluor-Ionen eingehen kann, wo doch Edelgase reaktionsträge sind? Die wichtigste Voraussetzung für eine Bindung ist auch bei Krypton, dass es eine Wertigkeit aufweist. Bei Kryptondifluorid muss Krypton über zwei positive Wertigkeiten verfügen. Diese beiden Wertigkeiten weist nur das Kypton-Isotop Kr 82 auf! Indem zwei Neutronen an einer Siebenerreihe von Krypton fehlen, haben wir Krypton 82 vorliegen. Aufgrund der zwei unbesetzten Neutronenplätze ist Krypton 82 reaktiv und kann mit zwei elektrisch negativen Fluor-Ionen eine Bindung eingehen (Abb. 4).
Fazit
Ein Atom besteht nicht aus Atomkern und Atomhülle, sondern ist ein aus zwei Bausteinarten zusammengesetztes, kompaktes Gebilde. Aufgrund der Rotationseigenschaften von Proton und Neutron bauen sich Atome schachbrettartig auf. Am Beispiel des Elements Krypton und seiner Isotope konnte mit dem schachbrettartigen Atomaufbau gezeigt werden, warum die Isotope ein bestimmtes Spektrum von Atommassen aufweisen und weshalb darüber hinaus keine leichteren oder schwereren Isotope möglich sind. Es wurde verdeutlicht, dass auch die künstlich hergestellten Isotope eines Elements dem schachbrettartigen Atomaufbau unterliegen. Dabei konnte auch der Unterschied zwischen reaktiven und nicht reaktiven Isotopen Kryptons, anhand des Isotops Kr 82 gezeigt werden. Während die Wertigkeit von Kr 84 „0“ ist, verfügt Kr 82 über die Wertigkeit „2“. Nur aufgrund dieser Wertigkeit kann es zu einer Reaktion zwischen Krypton und Fluor kommen. Krypton verfügt über 42 Protonen, weshalb auch die Ordnungszahl des Edelgases „42“ lauten muss. Dadurch muss in Zukunft das Periodensystem der Elemente neu geordnet werden.
Helmut Albert, Freiburg im Juli 2021
Literaturnachweise:
Albert, H. (Hg.) Albert G. sen. (2017). Atommodell mit schachbrettartiger Struktur, Verlag Helmut Albert, Freiburg. Neopubli –Druck, Berlin.
Bohr N. (1922). Über den Bau der Atome, Berlin, Verlag von Julius Springer 1924. Vortrag bei der Entgegennahme des Nobelpreises in Stockholm 1922. Übersetzung: W. Pauli jr.
Krypton(2019) online. Aktualisiert: 12.09.2019. https://www.internetchemie.info/chemische-elemente/krypton.php [Aufgerufen am: 04.07.2021]
Krypton-Isotope(2020) online. Aktualisiert: 05.07.2020. https://www.internetchemie.info/chemische-elemente/krypton-isotope.php [Aufgerufen am: 04.07.2021]
Mendelejew Dmitri (1870). Die periodische Gesetzmäfsigkeit der chemischen Elemente. Zweites Heft.(Übersetzer: Felix Wreden) S. 139 -229. Annalen der Chemie und Pharmacie. Herausgegeben und redigirt von Friedrich Wöhler, Justus Liebig und Hermann Kopp. VII. Supplementband. Leipzig und Heidelberg. C.F. Winter´sche Verlagshandlung. 1870.
Meyer Lothar (1870). Die Natur der chemischen Elemente als Function ihrer Atomgewichte. Drittes Heft. S.354-364. Annalen der Chemie und Pharmacie. Herausgegeben und redigirt von Friedrich Wöhler, Justus Liebig und Hermann Kopp. VII. Supplementband. Leipzig und Heidelberg. C.F. Winter´sche Verlagshandlung. 1870.





Ich finde das Thema sehr spannend. Ich fände es bemerkenswert wenn sich die „Elite“ hier irrt.
Gruß aus der Talstraße
LikeGefällt 1 Person
Möglicherweise stehen wissenschaftliche Institutionen unter hohem Anpassungsdruck! Dabei geht es mehr darum einen Mythos zu pflegen, als eine traditionelle Vorstellung umzuwerfen!
LikeLike