Nach den bisherigen Vorstellungen der Wissenschaft sind die chemischen Bindungen der Atome von den Elektronen der Atomhülle abhängig. Wie schon vor mehr als 100 Jahren geht die Wissenschaft auch heute noch von der Vorstellung eines Elektronensystems in der Atomhülle aus. Daran ändert auch die Tatsache nichts, dass Elektronen nach der Quantenphysik inzwischen nicht als Teilchen, sondern als Wellen in Erscheinung treten sollen.
Allerdings macht die Vorstellung von Elektronen als Wellen die Elektronen- und Molekültheorie nicht einfacher, sondern komplizierter. Vor allem deshalb, weil damit das einst von Niels Bohr als BESETZUNGSSYSTEM ausgearbeitete Elektronensystem ins Wanken gerät. Man kann sich noch ein Besetzungssystem mit Teilchen vorstellen, mit einen Raumbereich der nur 2 oder 8 Teilchen aufnehmen kann und dann vollständig besetzt ist. Raumbereiche oder Orbitale, die aber nur eine bestimmte Anzahl von Wellen aufnehmen können, sind dagegen schwer vorstellbar. Die Frage wie solche Bereiche abgegrenzt sein sollen und andere Fragen lassen diese Theorie absurd erscheinen.
Auch wenn Bohrs Vorstellung eines Besetzungssystem nachweislich unrealistisch ist, so hat seine Vorstellung doch eine gewisse Logik. Was die Quantenphysik daraus machte, ist aber unlogisch und paradox. Es werden völlig unvereinbare Vorstellungen miteinander verknüpft. Insofern sind Aussagen von Quantenphysikern, wie die, dass man sich ein Atom gar nicht vorstellen soll, nachvollziehbar. Es sei sowieso unmöglich, sich ein Bild vom Atom zu machen. Doch das Gegenteil ist richtig, die Vorstellung vom Atombau ist die einzige Möglichkeit, ein „logisches“ Bild vom Atom zu erhalten.
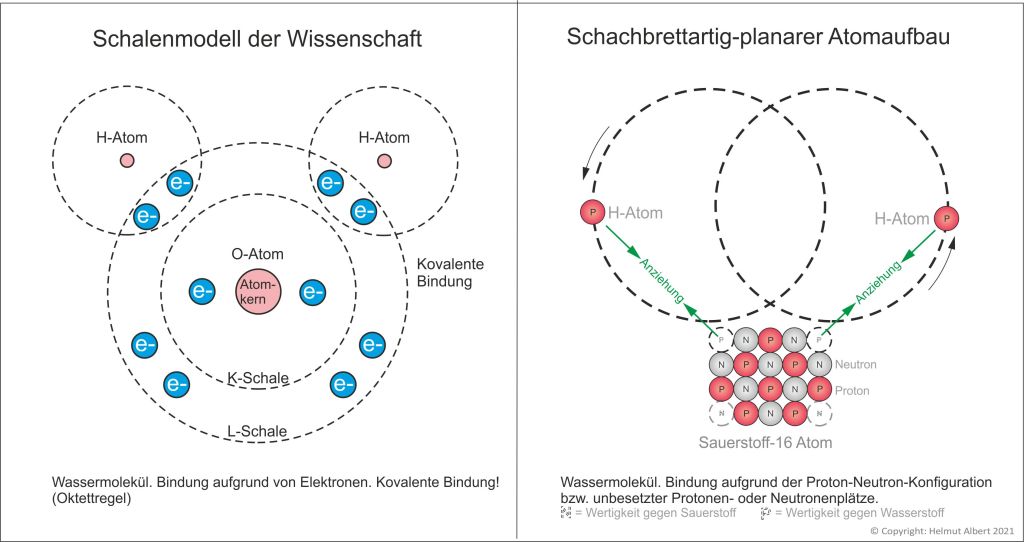
Es sind nicht die Elektronen, die Bindungen der Atome bewirken, sondern die Protonen-Neutronen-Konfigurationen der Atome!
Am Beispiel des Wassermoleküls lassen sich die Bindungen gut demonstrieren. Das Sauerstoff-Atom-16, dem gegenüber dem Neon-Atom-20 zwei Protonen und zwei Neutronen an seinen Ecken fehlen, hat also zwei Valenzen gegen Wasserstoff und zwei Valenzen gegen Sauerstoff. Die beiden Valenzen gegen Wasserstoff sind Wirkungen der beiden fehlenden Protonen. Diese unbesetzten Protonenplätze ziehen die beiden Wasserstoffatome (Protonen) an. Durch das gegenseitige Umkreisen der beiden Wasserstoffatome (Wasserstoffmolekül) reicht die Anziehungskraft des Sauerstoffatoms aber nicht aus, um sie als Bausteine in das Sauerstoffatom einzubauen. Stattdessen binden und lösen sich die Wasserstoffatome immer wieder vom Sauerstoffatom, was einen ständigen Austausch der H-Atome bedeutet, der als Autoprotolyse bekannt ist.





Hinterlasse einen Kommentar