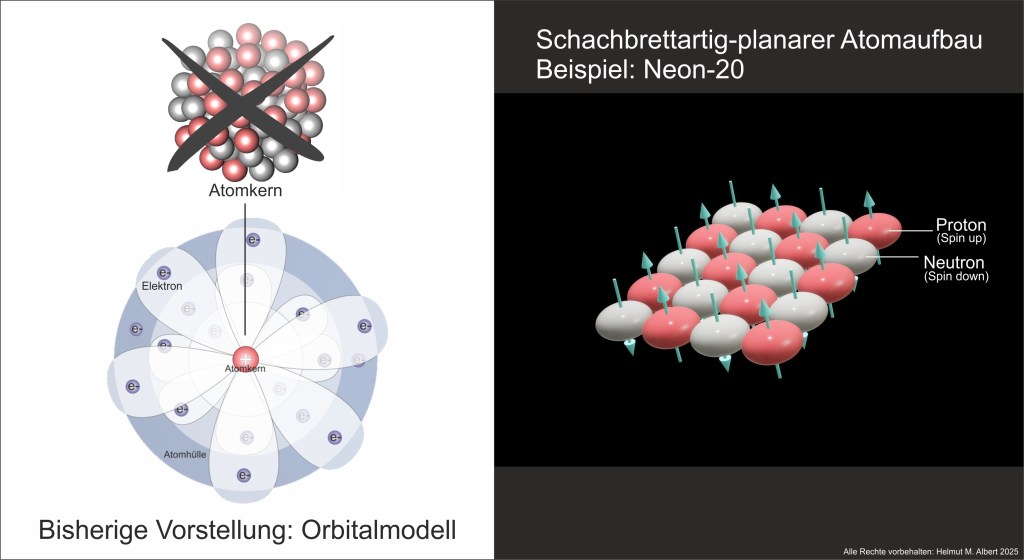
Anlässlich seiner Nobelpreisverleihung im Jahr 1922 meinte der Physiker Niels Bohr, das Atom sei einem Planetensystem ähnlich (vgl. Bohr 1922: 10). Diese Vorstellung eines zentralen Atomkerns mit einer Elektronenhülle ist bis heute erhalten geblieben. Die Vorstellung, dass die Elektronen um den Atomkern kreisen, erwies sich jedoch bald als Irrtum. Mit Beginn der Quantenphysik um 1925 wurde auch der Welle-Teilchen-Dualismus postuliert, demzufolge Elektronen sowohl Teilchen als auch Wellen sind. Die Überlegung war: Wenn ein elektrisch negatives Elektron auch eine Welle sein kann, kann es nicht in den elektrisch positiv geladenen Kern stürzen. Damit war der Übergang vom Bohrschen Atommodell zum heutigen Orbitalmodell vollzogen. Genau bei diesen Theorien der Quantenphysik zeigen sich die Schwächen des Orbitalmodells. Es ist von allem ein „bisschen” dabei. Die Uneindeutigkeit der Quantenphysik wurde zum Prinzip erhoben und als große Erkenntnis gefeiert. Doch „Uneindeutigkeit“ ist kein Merkmal der Natur, sondern der modernen Wissenschaft.
Im Welle-Teilchen-Dualismus sind Elektronen sowohl Welle als auch Teilchen. Das ist in etwa so, als würde man einem fahrenden Motorboot auf einem See sowohl Eigenschaften eines Körpers als auch einer Welle zuschreiben. Es verursacht die Welle, ist aber nicht die Welle selbst. Auch winzige Elementarteilchen, die schwingen oder kreisen, stoßen sich gegenseitig ab und verursachen Wellen, sind aber nicht die Wellen selbst.
Elementarteilchen können also nicht sowohl Welle als auch Teilchen sein, aber sie können Bestandteil einer Welle sein.
Auf solchen Vorstellungen von Welle-Teilchen-Elektronen sollen laut Lehrmeinung auch die chemischen Bindungen mit anderen Atomen beruhen. Demnach sollen bei einer chemischen Reaktion Elektronen eines neutralen Atoms zu einem anderen überspringen, um die Edelgasregel zu erfüllen. Das würde bedeuten, dass die Edelgasregel eine stärkere Anziehung auf ein Elektron ausübt als die elektromagnetische Anziehung zwischen elektrisch entgegengesetzt geladenen Teilchen. Doch woher soll die Energie kommen, die ein negativ geladenes Teilchen (oder eine Welle) aus einem elektrisch neutralen System löst? Während aufgrund elektromagnetischer Anziehung und Abstoßung Motoren betrieben werden können, sind Motoren, die auf der Edelgasregel basieren, nicht bekannt. Die Edelgasregel wird bisher allein mit einem „Zahlenkult” gerechtfertigt. Eine besondere Stabilität von zwei, acht oder achtzehn Elektronen, ob als Teilchen oder Welle, ist nicht erkennbar.
Fazit: Die Wissenschaft hängt an der Vorstellung kugelförmiger Atome fest, weil Rutherford und Bohr den Atomaufbau vor über 100 Jahren wie ein Planetensystem beschrieben haben. Auch die folgenden Erkenntnisse und Entdeckungen der Protonen und Neutronen änderten daran nichts. Ebenso bewirkte der 1925 entdeckte und postulierte Spin von Teilchen nur wenig im Denken. Er wurde als Quantenzahl bzw. als Eigenschaft notiert und die Theorien wurden komplizierter. Tatsächlich ist der Spin nicht nur eine Eigenschaft wie andere, sondern die grundlegende Energie und Kraft, die dem gesamten Materieaufbau zugrunde liegt. Geheimnisvolle und virtuelle Kraftteilchen, sog. Bosonen sind deshalb unsinnig und tragen nicht zum Verständnis des Atomaufbaus bei. Die der Lehrmeinung entgegen gesetzte Theorie des schachbrettartig-planaren Atomaufbaus wird von mir in den Arbeiten „2d-Atome“(2024) und „Periodensystem und 2d-Atomaufbau“(2025) genauer beschrieben.
Zusatz am 27.10.2025: Ursprungssjahre des Orbitalmodells: 1925 / 1926 (vgl. „Das Orbitalmodell“ S.6). https://www2.klett.de/sixcms/media.php/229/756123_0000.pdf
Quellenverzeichnis:
Bohr Niels (1922) Über den Bau der Atome, Berlin, Verlag von Julius Springer 1924. Vortrag bei der Entgegennahme des Nobelpreises in Stockholm 1922. Übersetzung W. Pauli jr.





Hinterlasse einen Kommentar