Nach heutiger wissenschaftlicher Auffassung ist das Kohlenstoffatom C12 vierwertig, manchmal auch zweiwertig!(vgl. Kohlenstoff 2022). Allgemein wird mit der Wertigkeit oder Valenz eines Atoms die Anzahl der einwertigen Bindungsmöglichkeiten angegeben, die ein Atom in der Lage ist einzugehen. Um die Wertigkeit eines Atoms zu berechnen bedient man sich einer Regel. Danach entsprechen die Wertigkeiten der Atome der ersten vier Hauptgruppen ihrer jeweiligen Hauptgruppenzahl. Bei den Atomen der Hauptgruppen 5 – 8, zieht man dagegen die Hauptgruppenzahl von der Gesamtgruppenzahl 8 ab und erhält dann die Wertigkeit. Die kleinere Zahl soll danach immer die Wertigkeit anzeigen.
So ist zumindest die heutige Lehrmeinung. Dabei wird deutlich, dass die Regeln zur Ermittlung der Wertigkeit oberflächlich sind. Auf diese Weise ist beispielsweise nicht feststellbar, ob es sich bei einer Wertigkeit, die man mit dieser Regel erhält, um eine negative oder positive Wertigkeit handelt. Das Problem, eine präzise Wertigkeit eines Atoms zu erhalten, wird sich aber mit der heutigen Atomvorstellung nicht ändern. Diese Atomvorstellung geht nämlich davon aus, dass Elektronen in einer Atomhülle entscheidend für das chemische Verhalten und die chemischen Bindungen der Atome sind. D.h. die Ermittlung von Wertigkeiten ist an die schematische Vorstellung eines Elektronensystems gebunden. Doch diese bisherige Vorstellung ist ein Irrtum.
Es existiert schlicht kein Elektronensystem des Atoms!
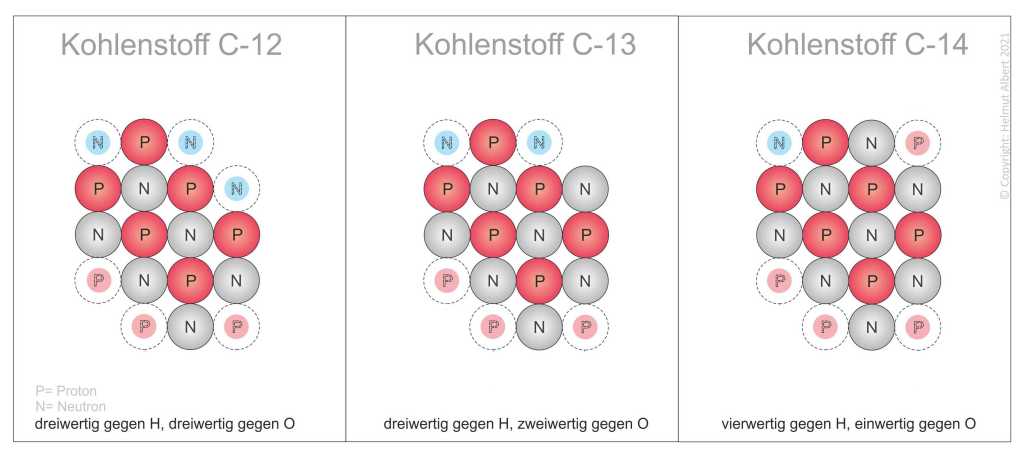
Stattdessen ist die Protonen-Neutronen-Konfiguration für das chemische Verhalten und die chemischen Bindungen verantwortlich. Mit dem schachbrettartig-planaren Atomaufbau sind alle Isotope eines Elements bezüglich ihrer Wertigkeit darstell- und berechenbar. Das Beispiel der natürlichen Kohlenstoffisotope zeigt in der Abbildung oben, was die Ursache einer Wertigkeit ist und wie die Wertigkeit bestimmt werden kann.
„Wie alle Wirkungen, die vom Atom ausgehen, beruht auch die Wertigkeit auf der Protonen-Neutronen-Konfiguration und dem schachbrettartigen Atomaufbau. Dabei ist zu trennen zwischen der Wertigkeit gegen Wasserstoff und gegen Sauerstoff. Die Wertigkeit gegen Wasserstoff beruht auf unbesetzten Protonenplätzen(P), während die Wertigkeit gegen Sauerstoff auf unbesetzten Neutronenplätzen(N) Siehe Abbildung 2. Voraussetzung für eine Wertigkeit ist, dass ein unbesetzter Platz von mindestens zwei Nukleonen flankiert wird. Aufgrund der unterschiedlichen Protonen-Neutronen-Konfigurationen unterscheiden sich die Wertigkeiten der Elemente“( Albert 2021:11).
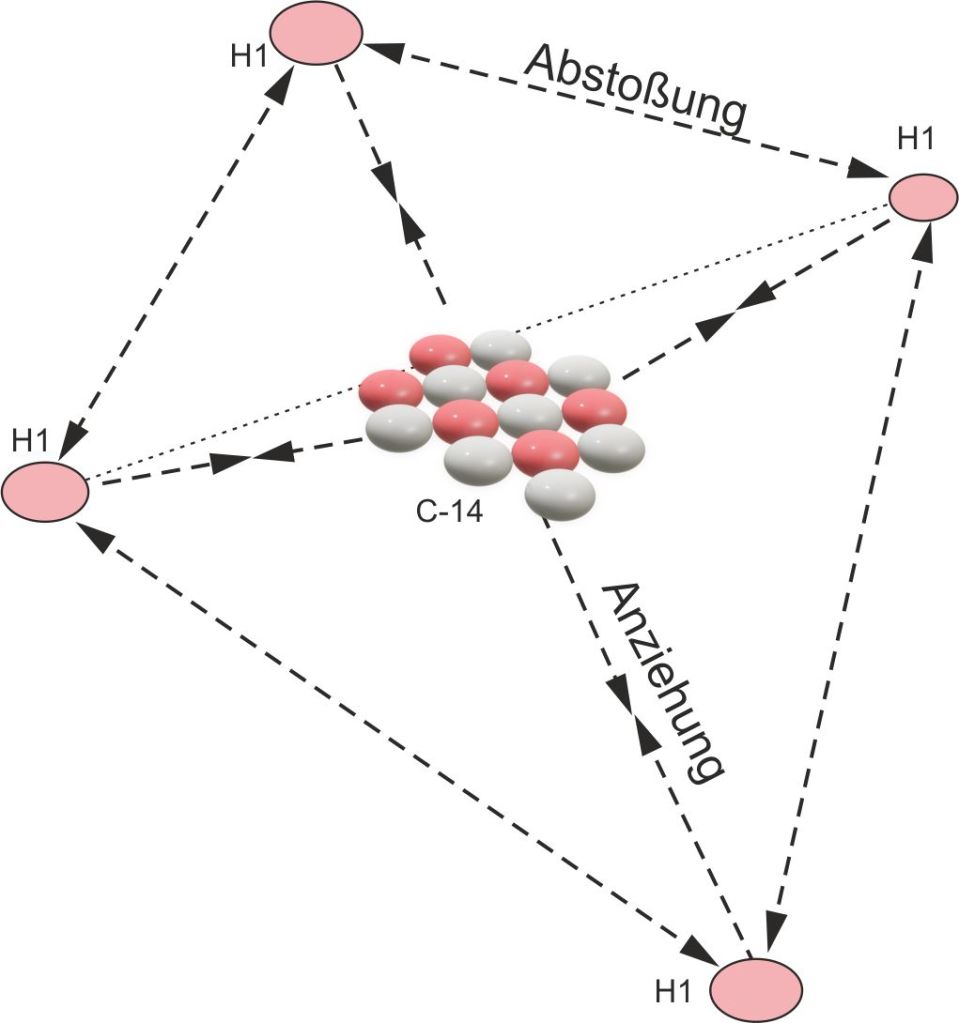
Die Abbildungen oben/unten, machen deutlich, dass nicht das Isotop C 12, sondern C14 vierwertig ist. Das Kohlenstoffisotop C12 hingegen weist mit 3 Wertigkeiten gegen Wasserstoff und 3 Wertigkeiten gegen Sauerstoff ein ausgeglichenes Verhältnis der Wertigkeiten auf. Aufgrund dieser Wertigkeiten ist es möglich, dass Kohlenstoff 12 riesige Moleküle, bzw. zweidimensional aufgebaute Atomschichten (Graphen) bilden kann. Das Kohlenstoffisotop C14 dagegen ermöglicht das Methanmolekül CH4. Dabei stoßen sich die 4 Wasserstoffatome von Methan gegenseitig ab und bilden ein Tetraeder, in den das Kohlenstoffatom 14 eingebunden ist(Siehe Abbildung unten).
Literaturverzeichnis:
Albert Helmut, 2021. Kohlenstoff. Der schachbrettartig-planare Atomaufbau. (Heftbindung). Verlag, Helmut Albert, Freiburg im Breisgau. Druck: neopubli, Berlin. Erscheinungsdatum: 24.12.2021. ISBN: 978-3-754934-92-0.
Kohlenstoff. 2022. Lexikon der Chemie (online) Spektrum Akademischer Verlag, Heidelberg.https://www.spektrum.de/lexikon/chemie/kohlenstoff/4951 (Abgerufen: 05.11.2022)





Hinterlasse einen Kommentar