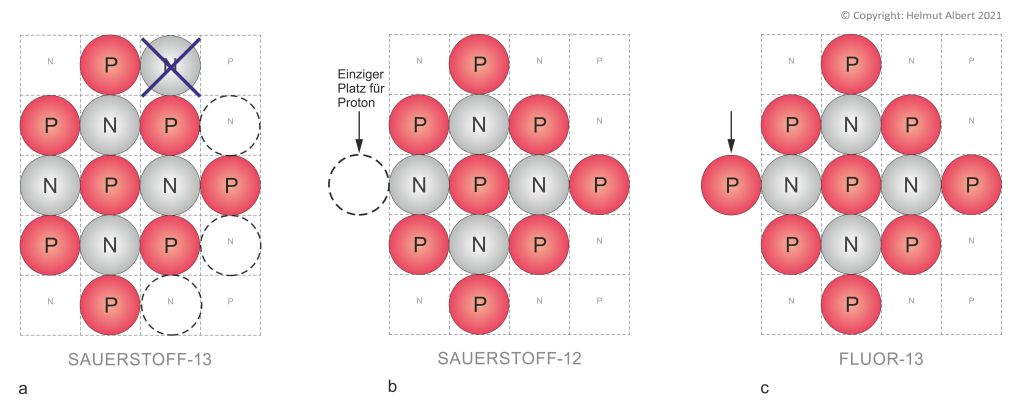
Abb. 2a, b, c. Künstliche Isotope. O-13, O-12, F-13
Fluor-Isotope
Bisher war unbekannt, dass Fluor-13 künstlich herstellbar ist. In der Natur kommt das Element Fluor nur als Reinelement Fluor-19 vor. Alle anderen bekannten Isotope des Elements Fluor werden künstlich hergestellt. Das Spektrum dieser Isotope, reicht nach offiziellen Angaben, von F-14 bis F-31 (Fluor 2021). Isotope eines Elements unterscheiden sich aufgrund der unterschiedlichen Anzahl an Neutronen und damit Atommassen.
Experiment
2021 konnte nun erstmals ein Fluor-Isotop hergestellt werden, welches über ein Neutron weniger verfügt, als das bisher leichteste Isotop F-14. Forscher der Washington University / St. Louis bestätigten die Entdeckung des Isotops F-13. Nach ihren Informationen war die Entdeckung wohl eher ein Zufall. Eigentlich untersuchen die Forscher sehr leichte Sauerstoffisotope als sie bemerkten, dass sich beim Experiment kurzzeitig das Isotop F-13 bildete, ein Isotop das bisher unbekannt war. Nach ihrer Beschreibung war das Sauerstoff-Isotop O-13 der Ausgangspunkt ihrer Untersuchungen. Dabei soll bei einer „Ladungsaustauschreaktion“(Charity et al. 2021) ein Neutron mit einem Proton ausgetauscht worden sein. Überraschenderweise wurde ein Proton von dem leichten Sauerstoff-Atom aufgenommen. Im Anschluß wurde der Zerfall von F-13 über O-12 beobachtet(vgl. Charity et al. 2021).
Interpretation aufgrund des schachbrettartig-planaren Atomaufbaus:
Mit dem geschilderten Experiment konnten die Forscher Fluor-13 nachweisen, wenngleich es nur kurzzeitig existierte. Damit ist aber die Frage nicht beantwortet: Warum Fluor-13 möglich ist? Es stellt sich ausserdem die Frage ob auch Fluor-12 möglich ist? Aufgrund der bisherigen Atommodelle ist es unmöglich solche Experimente nachzuvollziehen. Deshalb weil den bisherigen Atommodellen der Bezug zur Wirklichkeit des Atomaufbaus fehlt. Mit dem auf diesem Blog vorgestellten schachbrettartig-planaren Atommodell ist der Atomaufbau einfach und logisch zu verstehen. Danach bauen die Protonen und Neutronen die Atome schachbrettartig abwechselnd von innen nach außen auf. (vgl. Albert 2019:17ff.).
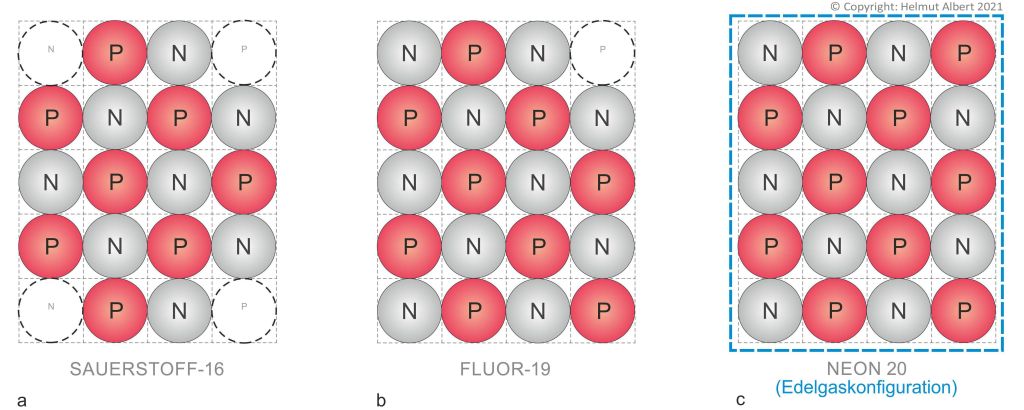
Verfolgen wir nun das o.g. Experiment indem wir es auf Grundlage des schachbrettartigen Atomaufbaus nachvollziehen. Der planare Atomaufbau beginnt mit dem Helium-Atom das bereits mit 2×2 Atombausteinen ein geschlossenes Atomrechteck bildet und deshalb über die Edelgaskonfiguration verfügt. Das nächste Edelgas-Atom, Neon-20, stellt mit 4×5 Bausteinen ebenfalls ein geschlossenes Atomrechteck dar. Entfernen wir an einem Eck dieser Konfiguration ein Proton dann haben wir Fluor-19 vorliegen. Um von da aus zu Sauerstoff-16 zu gelangen müssen wir noch ein Proton und zwei Neutronen an den Ecken des Atoms entfernen. (siehe Abb. 1a, b, c).
Warum Fluor-13 möglich ist!
Sauerstoff verfügt nach offiziellen Angaben über insgesamt fünfzehn Isotope, davon sind drei natürlich. Das leichteste Sauerstoff-Isotop ist danach O-12(Sauerstoff 2021). Oben haben wir bereits den Aufbau des natürlichen Isotops O-16 nach dem schachbrettartig-planaren Atomaufbau sehen können. Gehen wir nun ebenso vor, wie die Forscher bei ihrem Experiment. Ausgangspunkt waren dabei die leichten Sauerstoff-Atome. Betrachten wir das Isotop O-13 in der Abbildung 2a. Der schachbrettartige Atomaufbau zeigt, von den Neutronen des Atoms O-13 kann nur noch ein einziges Neutron entnommen werden (Kreuzchen), ohne das Atom sprengen. Entfernen wir dieses Neutron, haben wir O-12 vorliegen, wie es in Abbildung 2b zu sehen ist. In diesem Zustand des Isotops O-12 können Neutronen zwar hinzugefügt werden, es können aber keine mehr entnommen werden. Auch dieser Atomaufbau ist wegen des Protonen-Überschusses instabil. Um Fluor-13 herzustellen muss O-12 noch ein Proton hinzugefügt werden. Der einzig noch mögliche Platz um ein Proton hinzuzufügen ist in Abb. 2b, mit einem gestrichelten Kreis gekennzeichnet. Dieser Bausteinplatz ist außerhalb des natürlichen Atomaufbaus (Siehe Atomaufbau Abb. 1a, 1b). Nachdem das Proton hinzugefügt wurde sehen wir Fluor-13, als quadratisch-planar aufgebautes Atom (Abb. 2c). Es ist klar, dass Fluor-13 aufgrund des hohen Protonen-Überschusses nur sehr kurzzeitig existieren kann. Anhand dieser künstlichen Protonen-Neutronen-Konfiguration wird ebenfalls deutlich, dass kein leichteres Fluor-Isotop als F-13 möglich ist, da kein weiteres Neutron entnommen werden kann. Das gleiche gilt für Sauerstoff-12; auch bei diesem Isotop ist kein leichteres Isotop mehr möglich. Siehe Abb. 2b.

(Text und Illustrationen: Helmut Albert, Dez. 2021)
Quellenverzeichnis:
Albert, Helmut (Hg.) 2019 . Theorie des planaren und schachbrettartigen Aufbaus der Atome. Verlag Helmut Albert, Freiburg. Epubli –Druck, Berlin. ISBN: 978-3-750240-32-2
Fluor-Isotope 2021.o. V. (online) Die naturwissenschaftliche Wissensdatenbank. Internetchemie.info. https://www.internetchemie.info/chemische-elemente/fluor.php (Abgerufen 16.12.2021)
R. J. Charity, T. B. Webb, J. M. Elson, D. E. M. Hoff, C. D. Pruitt, L. G. Sobotka, K. W. Brown, G. Cerizza, J. Estee, W. G. Lynch, J. Manfredi, P. Morfouace, C. Santamaria, S. Sweany, C. Y. Tsang, M. B. Tsang, Y. Zhang, K. Zhu, S. A. Kuvin, D. McNeel, J. Smith, A. H. Wuosmaa, and Z. Chajecki (online). Phys. Rev. Lett. 126, 132501 – Published 30 March 2021 (Abgerufen 14.12.2021)
Sauerstoff-Isotope 2021.o. V. (online) Die naturwissenschaftliche Wissensdatenbank. Internetchemie.info. https://www.internetchemie.info/chemische-elemente/sauerstoff-isotope.php (Abgerufen 16.12.2021)





Hinterlasse einen Kommentar