Wertigkeit.
Die Wertigkeit eines Atoms beschreibt mit wie viel einwertigen Atomen, dieses Atom eine chemische Verbindung eingehen kann. Sie wird auch als „Valenz“, bezeichnet, was von der Wortherkunft „Stärke oder Kraft“ bedeutet(vgl. Wertigkeit 2021). Traditionell wird die Wertigkeit, entweder gegen Wasserstoff oder gegen Sauerstoff angegeben.
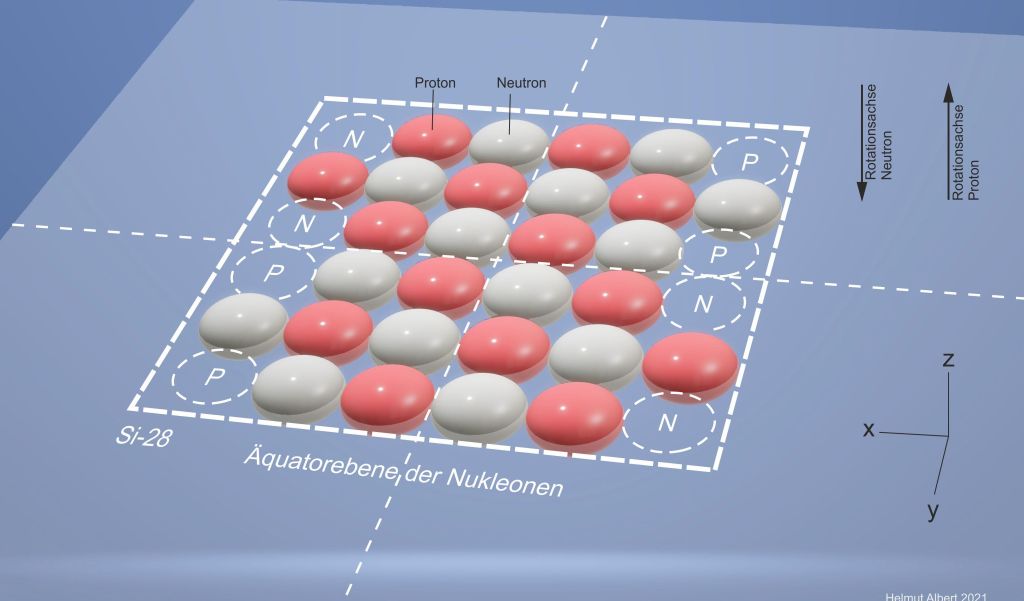
Die Wertigkeit nach der Theorie des schachbrettartig-planaren Atomaufbaus.
Das als „Atomkern“ bezeichnete System der Protonen und Neutronen wurde bisher von der Wissenschaft mehr oder weniger als Atomkugel betrachtet, die kaum was zu den chemischen Eigenschaften eines Elements beiträgt. Die chemischen Eigenschaften der Elemente sind danach von den Elektronen der sog. Atomhülle abhängig. Doch eine solche Atomhülle als Bestandteil eines Atoms ist Fiktion, sieht man davon ab, dass ein elektrisch geladenes Atom von einem Kraftfeld umgeben ist. Zweifellos sind Atome aber Besetzungssysteme. In der Theorie des schachbrettartig-planaren Atomaufbaus erfolgt die für die chemischen Eigenschaften entscheidende Besetzung aber nicht durch (masselose) Elektronen, sondern durch Protonen und Neutronen im Atomkern. Wobei der Begriff „Atomkern“ überflüssig ist, da er das gesamte Atom schon bezeichnet.
Die Atomgeometrie wird durch den schachbrettartig-planaren Aufbau der Protonen und Neutronen vorgegeben. Sie bildet den Rahmen für das Besetzungssystem der Atome. Dabei ergeben sich nach dem PSE, aufgrund ansteigender Protonen- und Massezahlen, offene und geschlossene Atomrechtecke. Die Protonen-Neutronen-Konfigurationen weist sowohl „vollständig besetzte“, als auch „unvollständig besetzte“ Atome auf. Mit der vollständigen Besetzung eines Atomrechtecks oder –quadrats verfügt ein Atom über die Edelgaskonfiguration. Unvollständig besetzte Atomrechtecke sind die Atome der I. bis VII. Hauptgruppe, aufgrund ihrer Wertigkeiten können sie sich in einer Reaktion mit anderen Atomen(Ionen) verbinden. Da die Nukleonen die Atome von innen nach außen quadratisch bzw. rechteckig aufbauen, befinden sich unbesetzte Nukleonenplätze ausschließlich in den äußeren Bausteinreihen des Atoms. Ein unbesetzter Nukleonenplatz eines Atoms stellt eine Wertigkeit dar, sofern er von zwei Nukleonen flankiert wird. Je nachdem ob es sich um einen unbesetzten Protonen- oder Neutronenplatz handelt, besteht eine Wertigkeit gegen Wasserstoff oder Sauerstoff. (vgl. Albert 2017: 12f.) Wertigkeiten sind ungesättigte Energien der Nukleonen aufgrund einer bestimmten Protonen-Neutronen-Konfiguration. Deshalb kommt im Atomaufbau den unbesetzten Bausteinplätzen, eine ebenso große Bedeutung, wie den besetzten zu.

Von diesem Atomaufbau ausgehend können wir nun Rückschlüsse auf den Aufbau bestimmter Atome ziehen. Betrachten wir zu diesem Zweck das Silicium-Atom. Die Wertigkeit von Silicium wird in der Fachliteratur mit IV angegeben. Diese Vierwertigkeit bezieht sich auf das Silicium-Isotop 28. Doch Silicium 28 kann in verschiedenen Verbindungen sowohl eine Vierwertigkeit gegen Wasserstoff als auch gegen Sauerstoff aufweisen. Als Oxidationszahlen von Silicium bezeichnet man sie mit +4 und -4. Ganz im Gegensatz zur Vorstellung von vier Elektronen in den Valenzschalen eines Silicium-Atoms steht nun die Vorstellung des Silicium-Atoms nach dem schachbrettartig-planaren Atomaufbau.
Danach gibt die Atomgeometrie des Silicium-Atoms bereits den Rahmen für das Edelgas Argon mit 6 x 6 Nukleonen vor. Gehen wir umgekehrt vom vollständig mit Nukleonen gefüllten Argon-Atomquadrat aus. Um die Protonen-Neutronen-Konfiguration von Silicium zu erreichen müssen wir an zwei gegenüberliegenden Seiten des Atoms je zwei Protonen und zwei Neutronen wegnehmen. Damit erreichen wir ausgehend von der Massezahl 36 von Argon, die Massezahl 28 von Silicium. Somit weist das Atomquadrat von Silicium 14 Protonen und 14 Neutronen auf. Alle acht unbesetzten Plätze von Silicium stellen Wertigkeiten dar. Und zwar, vier Wertigkeiten gegen Wasserstoff und vier Wertigkeiten gegen Sauerstoff. Wie bei jeder chemischen Reaktion, kommt es auch bei Silicium auf die Bindungspartner an. Im Fall einer Verbindung mit Wasserstoff reagieren die unbesetzten Protonenplätze des Silicium-Atoms Bei einer Reaktion mit Sauerstoff dagegen sind die unbesetzten Neutronenplätze betroffen. Somit sind beim Silicium-Atom, wie bei allen reaktiven Atomen, die Wertigkeiten bereits im Grundzustand der Atome vorhanden. In einer chemischen Reaktion geht es darum, dass die Wertigkeiten und damit Ladungen des Silicium-Atoms in gleicher Anzahl bei den Reaktionspartnern vorhanden sind. Bei einer Verbindung mit Wasserstoff gleichen sich die vier „negativen“ Wertigkeiten des Si-Atoms mit vier einwertigen „positiven“ Wertigkeiten der Wasserstoff-Atome aus. Bei Siliciumdioxid sind es dagegen die vier „positiven“ Wertigkeiten des Si-Atoms die sich mit den„negativen“ Wertigkeiten der vier Sauerstoffatome ausgleichen.
Bis auf Wasserstoff mit nur einer Wertigkeit gegen Sauerstoff, beruhen alle Wertigkeiten der Atome auf unbesetzten Protonen- oder Neutronenplätzen.
Quellenverzeichnis:
Albert, Helmut (Hg.) Albert Georg (2017). Atommodell mit schachbrettartiger Struktur, Verlag Helmut Albert, Freiburg. Epubli –Druck, Berlin.
Wertigkeit. In: Wikipedia – Die freie Enzyklopädie. Bearbeitungsstand: 23. August 2021, 07:34 UTC. URL: https://de.wikipedia.org/w/index.php?title=Wertigkeit&oldid=214982920 (Abgerufen: 22. Oktober 2021, 11:24 UTC)





Hinterlasse einen Kommentar